Biopsie de la prostate par voie périnéale, sous guidage échographie avec Fusion d’une imagerie par résonance magnétique multiparamétrique (IRMmp) de la prostate
Technique innovatrice de dépistage et de diagnostic du CANCER DE LA PROSTATE.
Nos urologues sont parmi les premiers au Canada à offrir ce service (par voie périnéale) à leurs patients.
Les tests de l’APS et du toucher rectal sont des outils importants dans le dépistage du cancer de la prostate, mais ils soulèvent souvent des questions sans réponse précise.
Quant aux biopsies systématiques de la prostate, elles ne donnent pas toujours suffisamment d’informations sur la maladie pour qu’elles soient concluantes.
Dans de nombreux cas, la IRMmp de la prostate s’avère efficace dans l’identification des lésions suspectes et localisées.
Fusionner des images échographiques de grande qualité en temps réel avec des données IRMmp pré-examen, offre un meilleur guidage pour cibler avec précision les lésions identifiées.
Cette nouvelle approche réduit potentiellement le risque de manquer des tumeurs de la prostate à haut risque, qui nécessitent véritablement un traitement.
Les tumeurs de bas risque s’orientent le plus souvent vers une surveillance active.
De plus, la fusion avec biopsies par voie périnéale réduit le risque de sepsis auquel un patient s’expose lors d’une fusion avec biopsies transrectales.
Dans Les Cliniques Marois, nous effectuons la Fusion Prédictive® de la BK Fusion qui utilise un enregistrement et un algorithme rigides, pour réorienter la position de la prostate sur l'image IRMmp en une position échographique plus naturelle. Un grand avantage avant la procédure du patient.
Il y a consensus que cette technologie est beaucoup plus précise que l’ancienne fusion élastique.


Pourquoi faire une imagerie par résonance magnétique de la prostate?
L’utilisation de l’IRM pour la détection du cancer de la prostate représente la dernière révolution dans le domaine du diagnostic de ce cancer. Jusqu’à son développement, l’échographie traditionnelle de la prostate permettait de cibler la prostate, mais pas la tumeur; le cancer de la prostate était donc la seule néoplasie solide pour laquelle des prélèvements étaient faits à l’aveugle.
Les protocoles d’IRM modernes combinent des séquences T2, des séquences T1 avec produit de contraste et des séquences de diffusion. Chez un patient à risque, l’IRM est de plus en plus utilisée d’emblée comme outil de triage dans quelques départements de radiologie hospitaliers et cliniques de radiologie.
Elle permet d’obtenir une cartographie sur 27 régions d’intérêt. Chaque zone a un score – nommé Prostate Imaging-Reporting and Data System (Pi-RADS) – allant de 1 à 5, qui estime la probabilité d’y trouver un cancer cliniquement significatif. En cas de score Pi-RADS 1 (très improbable) ou 2 (improbable), la valeur prédictive négative de l’IRM multiparamétrique dans les centres d’excellence est de 90-95 %.
Le ciblage de lésions ayant un score Pi-RADS 3 (équivoque), 4 (probable) et 5 (très probable) permet un taux de détection supérieur des cancers cliniquement significatifs par rapport aux biopsies standards.
Il identifie 80-85% des lésions significatives (au moins Gleason 3+4). Cependant, 15-20% des lésions ne sont pas identifiées.
Ainsi, il y a 80% de chance de trouver un cancer de la prostate dans une lésion significative de PI RAD 4 et 5 à la RMN de la prostate.
Une RMN de la prostate négative, a toujours un risque que des tumeurs importantes soient présentes. La biopsie systématique est donc recommandée dans la même procédure. Elle ajoute au diagnostic que nous obtenons par la biopsie par fusion RMN puisqu’il y a environ 20% de chance de manquer un cancer de prostate.
L’injection d’une substance de contraste si possible, augmente la sensibilité de l’examen.
L’IRM semble être un outil idéal dans le cadre épidémiologique particulier du cancer de la prostate. Elle offre une meilleure détection des cancers cliniquement significatifs et une réduction substantielle du taux de détection des cancers indolents.
De plus, une IRMmp demeure souvent utile dans l’évaluation d’une tumeur localisée pour évaluer le volume, l’étendue, la localisation, le dépassement de la capsule et l’infiltration des vésicules séminales.
Qu’est-ce qu’une biopsie de la prostate par voie périnéale sous guidage échographie avec Fusion d’une RMNmp de la prostate ?
Une biopsie randomisée sans fusion est peu fiable; il y a un taux de faux négatifs élevé qui pourraient être de l'ordre de 25 à 35% pour un cancer significatif. Il peut nécessiter des biopsies à répétition avant de faire le diagnostic d’un cancer de prostate à haut risque.
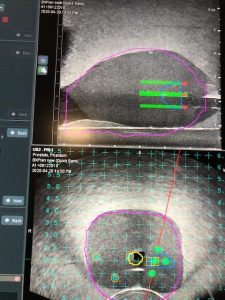
En préparation à la fusion, le contour de la prostate et des lésions significatives de la RMN sont identifiées par le radiologiste. Ils sont alors délimités par un logiciel MMS qui permet de faire le transfert des contours sur l’appareil d’échographie.
Les images sont alors superposées en temps réels lors de la biopsie de prostate par voie périnéale.
Le logiciel MIM de IRMmp de fusion de la prostate Prostate est entièrement intégré au système d'échographie BK 3000 premium de BK Ultrasound.
Il devient alors une BK Fusion.
Il est construit sur les capacités de fusion d'images multimodales du logiciel MIM.
Il exploite sa technologie brevetée Predictive Fusion pour la fusion IRMmp de la prostate pendant la biopsie.
Predictive Fusion « recoupe » et pré-aligne les images IRMmp de la prostate pour correspondre à l'orientation de la prostate pendant la biopsie, puis les fusionne avec les images de l’échographie au moment de la biopsie, ce qui permet de gagner du temps pendant la procédure.
Cette avancée dans le ciblage par IRMmp de la prostate aide à atteindre un taux de détection du cancer de la prostate plus élevé par rapport à la biopsie transrectale traditionnelle par échographie.
Les patients bénéficieront d'une biopsie plus précise et fiable en cas de cancer de la prostate.
Pour conclure, il s’agit donc d’une avancée significative dans la visualisation et le guidage, afin d’améliorer les résultats cliniques grâce à une fusion IRMmp-vers-échographie en temps réel pendant la biopsie de prostate par voie périnéale.
Est-ce que tous les patients sont des candidats pour une biopsie de la prostate par voie périnéale sous échographie avec Fusion d’une IRMmp de la prostate ?
Actuellement les infrastructures et les ressources de résonance magnétique de la plupart des hôpitaux du Québec ne permettent malheureusement pas l’intégration de l’IRMmp de la prostate. Les délais d’accès sont déjà longs pour l’ensemble de demandes, tout organe confondu. Elle est cependant accessible dans quelques cliniques de radiologie spécialisées. Son coût demeure toutefois élevé.
Patients sans antécédent de biopsies de la prostate
Les patients qui ont des tumeurs volumineuses et palpables, n’ont généralement pas besoin d’une biopsie de la prostate avec fusion.
Et les patients ayant eu un résultat négatif de biopsie de la prostate?
Une IRMmp demeure souvent utile dans l’évaluation d’une tumeur localisée pour évaluer le volume, l’étendue, la localisation, le dépassement de la capsule et l’infiltration des vésicules séminales.
L’IRMmp est également utilisée pour effectuer un bilan d’extension ou dans le cadre d’un protocole de surveillance active chez les patients ayant un diagnostic de cancer de la prostate.
Est-ce qu’il y a d’autres avantages d’une biopsie de la prostate par voie périnéale sous échographie avec Fusion d’une IRMmp de la prostate ?
Certains appareils utilisent le même logiciel pour le traitement localisé avec Fusion, tel que le HIFU.
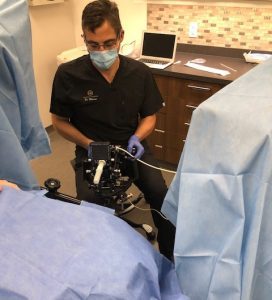
Comment se déroule une biopsie de la prostate par voie périnéale avec Fusion des images de l’IRMmp de la prostate et de l’échographie de la prostate?
Un rasage du périnée est réalisé, afin de coller une bande qui soulève le scrotum.
Dans un premier temps : l’anesthésie.
Après une désinfection de la région périnéale, une anesthésie locale de la peau et du périnée est réalisée à l’aide d'un injecteur cutané. Ceci est suivi d'une injection sous cutanée de xylocaïne, de chaque côté du rectum.
Une deuxième anesthésie est ensuite réalisée en profondeur près de la prostate. Les patients ressentent généralement une sensation de chaleur plutôt que de douleur.
L'anesthésie est le moment le plus désagréable de la procédure.
Dans un deuxième temps : introduction d’une sonde d'échographie endorectale.
Une échographie endorectale consiste à obtenir des images de la prostate, grâce à une sonde d’échographie introduite par l’anus à l’intérieur du rectum.
Dans le cas de la fusion, il y un bras articulé qui soutient la sonde. Un grillage stérile est utilisé pour diriger l’aiguille dans les zones identifiées. Les zones de fusion sont par la suite identifiées.
Finalement : biopsies de la prostate.
La sonde échographique est équipée d’un système de guidage qui permet de visualiser le bon point d’entrée de l’aiguille dans la prostate et de suivre son trajet.
Dr Marois se sert d’une aiguille à déclenchement automatique. Ce mécanisme produit un claquement sec qui peut surprendre la première fois. La piqûre elle-même est parfois un peu inconfortable : l’aiguille pénètre très vite dans la prostate et en ressort aussi vite.
Par la suite, environ 6-10 prélèvements supplémentaires randomisées sont réalisés dans les autres parties de la prostate, si le patient n’a pas eu une biopsie récente.
Lorsque la série de prélèvements est terminée, des petits diachylons seront mis aux deux sites de prélèvements cutanés.
Ces prélèvements rapides et peu douloureux sont généralement bien supportés par le patient. L’inconfort augmente avec la durée de l’examen et le nombre de prélèvements. La plupart des hommes ne ressentent qu’un léger inconfort.
La durée d’une biopsie avec fusion est plus longue, soit de 30 à 45 minutes.
Quelles sont les complications possibles d’une biopsie par voie périnéale avec Fusion des images de l’IRMmp de la prostate et de l’échographie de la prostate?
Le risque de rétention urinaire est plutôt faible. Il est cependant plus élevé qu’une biopsie par voie transrectale.
Si vous ne réussissez pas à uriner après l'examen, une sonde urinaire peut être mis en place en bureau ou à l’urgence. Si tel est le cas, vous devez prendre un rendez-vous dans les jours suivants.
Comment obtient-on les résultats après une biopsie par voie périnéale avec Fusion des images de l’IRMmp de la prostate et de l’échographie de la prostate?
Lorsque les résultats ne montrent pas d’anomalies cancéreuses, on parle de résultats négatifs.
Lorsque nos urologues ont établi leur diagnostic, ils proposent alors un traitement adapté à la situation du patient.
Il y a 2 possibilités d’analyse pathologique :
Analyse pathologique en milieu hospitalier (aucun frais supplémentaire) : Les résultats de l’examen des biopsies de la prostate sont communiqués au médecin après un délai de plusieurs semaines. Un rendez-vous de suivi est proposé, environ un mois après la biopsie, afin qu'il transmette les résultats aux patients.
Analyse pathologique en milieu privé (frais supplémentaires) :
Il permet d’obtenir les résultats beaucoup plus rapidement (10-12 jours ouvrables). Le rendez-vous de suivi est alors prévu également une semaine après la biopsie. Un rendez-vous téléphonique peut être également prévu à cet effet, pour les patients habitant loin des cliniques.
Quelles sont les études?
National Comprehensive Cancer Network. Prostate Cancer. Version 2.2018.
Rozet F, Hennequin C, Beauval JB, Beuzeboc P, Cormier L, Fromont G, et al. CCAFU french national guidelines 2016-2018 on prostate cancer. Prog Urol. 2016; 27 Suppl 1: S95-S143.
Rendon RA, Mason RJ, Marzouk K, Finelli A, Saad F, So A, et al. Recommandations de l'Association des urologues du Canada sur le dépistage et le diagnostic précoce du cancer de la prostate. Can Urol Assoc J. 2017; 11(10): 298-309.
Hoffman RM, Elmore JG, O'Leary MP, Melin JA. Screening for prostate cancer. UpToDate (https://www.uptodate.com/contents/screening-for-prostate-cancer). 2019.
Fenton JJ, Weyrich MS, Durbin S, Liu Y, Bang H, Melnikow J. In Prostate-Specific Antigen-Based Screening for Prostate Cancer: A Systematic Evidence Review for the US Preventive Services Task Force. Rockville (MD), 2018.
Catalona WJ, Partin AW, Slawin KM, Brawer MK, Flanigan RC, Patel A, et al. Use of the percentage of free prostate-specific antigen to enhance differentiation of prostate cancer from benign prostatic disease: a prospective multicenter clinical trial. JAMA. 1998; 279(19): 1542-7.
US Preventive Services Task Force. Screening for Prostate Cancer: US Preventive Services Task Force Recommendation Statement. JAMA. 2018;319(18):1901–1913.
Bell N, Connor Gorber S, Shane A, Joffres M, Singh H, Dickinson J, et al. Recommendations on screening for prostate cancer with the prostate-specific antigen test. CMAJ. 2014; 186(16): 1225-34.
Collège des médecins du Québec. Le dépistage du cancer de la prostate - mise à jour 2013 - Lignes directrices du Collège des médecins du Québec. 2013, 33 pages.
Progensa PCA3 Assay. https://www.hologic.com/sites/default/files/2018-11/502083-IFU- PI_002_01.pdf.
Burruni R, Cerantola Y, Meuwly JY, Tawadros T, Jichlinski P, Valerio M. [Prostate biopsy: which strategy for which patient?]. Rev Med Suisse. 2015; 11(497): 2288-90, 92.
PROCURE – Halte au cancer de la prostate. Cancer de la prostate. Biopsie et Diagnostic (http://www.procure.ca/cancer-de-la-prostate/biopsie-et-diagnostic/) (consulté le 27 février 2019).
Truong M, Frye TP. Magnetic resonance imaging detection of prostate cancer in men with previous negative prostate biopsy. Transl Androl Urol. 2017; 6(3): 424-31.
Brown LC, Ahmed HU, Faria R, El-Shater Bosaily A, Gabe R, Kaplan RS, et al. Multiparametric MRI to improve detection of prostate cancer compared with transrectal ultrasound-guided prostate biopsy alone: the PROMIS study. Health technology assessment. 2018; 22(39): 1-176.
National Comprehensive Cancer Network. Prostate Cancer Early Detection. Version 2.2018.
National Institute for Health and Care Excellence. Transperineal template biopsy and mapping of the prostate (IPG364). 2010.
Sarkar S, Verma S. MR Imaging-Targeted Prostate Biopsies. Radiologic clinics of North America. 2018; 56(2): 289-300.
Weinreb JC, Barentsz JO, Choyke PL, Cornud F, Haider MA, Macura KJ, et al. PI-RADS Prostate Imaging - Reporting and Data System: 2015, Version 2. European urology. 2016; 69(1): 16-40.
Barentsz JO, Richenberg J, Clements R, Choyke P, Verma S, Villeirs G, et al. ESUR prostate MR guidelines 2012. Eur Radiol. 2012; 22(4): 746-57.
Turkbey B, Rosenkrantz AB, Haider MA, Padhani AR, Villeirs G, Macura KJ, et al. Prostate Imaging Reporting and Data System Version 2.1: 2019 Update of Prostate Imaging Reporting and Data System Version 2. European urology. 2019.
Unité d’évaluation des technologies et des modes d’intervention en santé (UETMIS) du CHU de Québec-Université Laval. Guide méthodologique – Démarche d’évaluation et étapes de réalisation d’un projet d’ETMIS. Québec, février 2019, 30 p.
Kung J, Chiappelli F, Cajulis OO, Avezova R, Kossan G, Chew L, et al. From Systematic Reviews to Clinical Recommendations for Evidence-Based Health Care: Validation of Revised Assessment of Multiple Systematic Reviews (R-AMSTAR) for Grading of Clinical Relevance. Open Dent J. 2010; 4: 84-91.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010; 182(18): E839-42.
Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med. 2011; 155(8): 529- 36.
Bossuyt PM, Reitsma JB, Bruns DE, Gatsonis CA, Glasziou PP, Irwig L, et al. STARD 2015: An Updated List of Essential Items for Reporting Diagnostic Accuracy Studies. Clin Chem. 2015; 61(12): 1446- 52.
National Institute for Health and Care Excellence. Prostate cancer: diagnosis and management (update), NICE guideline, 9 May 2019 https://www.nice.org.uk/guidance/ng131/resources/prostate-cancer- diagnosis-and-management-pdf-66141714312133.
The Nordic Cochrane Centre, The Cochrane Collaboration. Review Manager (RevMan). Version 5.3. Copenhagen: The Nordic Cochrane Centre, The Cochrane Collaboration, 2014.
Bjurlin MA, Carroll PR, Eggener S, Fulgham PF, Pinto PA, Rubenstein JN, et al. American Urology Association. MRI of the Prostate, Standard Operating Procedure (SOP). 2017.
Institut national d’excellence en santé et en services sociaux (INESSS) et Groupe d’étude en oncologie du Québec (GEOQ). Algorithmes d’investigation, de traitement et de suivi Cancer de la prostate.
American College of Radiology. ACR Appropriateness Criteria®. Prostate Cancer–Pretreatment Detection, Surveillance, and Staging. 2016.
Rozet F, Hennequin C, Beauval JB, Beuzeboc P, Cormier L, Fromont-Hankard G, et al. French CCAFU guidelines - Update 2018-2020: Prostate cancer. Prog Urol. 2018; 28(12S): S79-S130.
Haider, M., Yao, X., Loblaw, D. A., Finelli, A. and the MRI in Prostate Cancer Guideline Development Group. Multiparametric MRI in the Diagnosis of clinically significant Prostate Cancer. Toronto (ON): Cancer Care Ontario; 2015 Aug 5. Program in Evidence-based Care Guideline No.: 27-2.
Fandella A, Scattoni V, Galosi A, Pepe P, Fiorentino M, Gaudiano C, et al. Italian Prostate Biopsies Group: 2016 Updated Guidelines Insights. Anticancer research. 2017; 37(2): 413-24.
European Association of Urology. Prostate cancer guidelines. 2018.
Parker, C., Gillessen, S., Horwich, A. on behalf of the ESMO Guidelines Committee. eUpdate – Prostate Cancer Algorithms. 2015.
Futterer JJ, Briganti A, De Visschere P, Emberton M, Giannarini G, Kirkham A, et al. Can Clinically Significant Prostate Cancer Be Detected with Multiparametric Magnetic Resonance Imaging? A Systematic Review of the Literature. European urology. 2015; 68(6): 1045-53.
Moldovan PC, Van den Broeck T, Sylvester R, Marconi L, Bellmunt J, van den Bergh RCN, et al. What Is the Negative Predictive Value of Multiparametric Magnetic Resonance Imaging in Excluding Prostate Cancer at Biopsy? A Systematic Review and Meta-analysis from the European Association of Urology Prostate Cancer Guidelines Panel. European urology. 2017; 72(2): 250-66.
Cameron A, Tivey D, Duncan J, Scarfe A, Goodall S, van der Linden N, et al. Assessment of mpMRI prostate diagnostic scans for diagnosis of prostate cancer. MSAC Application 1397, Assessment Report. Commonwealth of Australia, Canberra, ACT. 2016.
Porpiglia F, Manfredi M, Mele F, Cossu M, Bollito E, Veltri A, et al. Diagnostic Pathway with Multiparametric Magnetic Resonance Imaging Versus Standard Pathway: Results from a Randomized Prospective Study in Biopsy-naive Patients with Suspected Prostate Cancer. European urology. 2017; 72(2): 282-8.
Ahmed HU, El-Shater Bosaily A, Brown LC, Gabe R, Kaplan R, Parmar MK, et al. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study. Lancet (London, England). 2017; 389(10071): 815-22.
Bladou F, Fogaing C, Levental M, Aronson S, Alameldin M, Anidjar M. Transrectal ultrasound- guided biopsy for prostate cancer detection: Systematic and/or magnetic-resonance imaging-targeted. Can Urol Assoc J. 2017; 11(9): E330-E7.
Boesen L, Norgaard N, Logager V, Balslev I, Thomsen HS. A Prospective Comparison of Selective Multiparametric Magnetic Resonance Imaging Fusion-Targeted and Systematic Transrectal Ultrasound- Guided Biopsies for Detecting Prostate Cancer in Men Undergoing Repeated Biopsies. Urol Int. 2017; 99(4): 384-91.
Distler FA, Radtke JP, Bonekamp D, Kesch C, Schlemmer HP, Wieczorek K, et al. The Value of PSA Density in Combination with PI-RADS for the Accuracy of Prostate Cancer Prediction. J Urol. 2017; 198(3): 575-82.
Hansen NL, Kesch C, Barrett T, Koo B, Radtke JP, Bonekamp D, et al. Multicentre evaluation of targeted and systematic biopsies using magnetic resonance and ultrasound image-fusion guided transperineal prostate biopsy in patients with a previous negative biopsy. BJU Int. 2017; 120(5): 631-8.
Hoffmann MA, Taymoorian K, Ruf C, Gerhards A, Leyendecker K, Stein T, et al. Diagnostic Performance of Multiparametric Magnetic Resonance Imaging and Fusion Targeted Biopsy to Detect Significant Prostate Cancer. Anticancer research. 2017; 37(12): 6871-7.
Mehralivand S, Bednarova S, Shih JH, Mertan FV, Gaur S, Merino MJ, et al. Prospective Evaluation of PI-RADS Version 2 Using the International Society of Urological Pathology Prostate Cancer Grade Group System. J Urol. 2017; 198(3): 583-90.
Pepe P, Garufi A, Priolo GD, Pennisi M. Multiparametric MRI/TRUS Fusion Prostate Biopsy: Advantages of a Transperineal Approach. Anticancer research. 2017; 37(6): 3291-4.
Alberts AR, Schoots IG, Bokhorst LP, Drost FH, van Leenders GJ, Krestin GP, et al. Characteristics of Prostate Cancer Found at Fifth Screening in the European Randomized Study of Screening for Prostate Cancer Rotterdam: Can We Selectively Detect High-grade Prostate Cancer with Upfront Multivariable Risk Stratification and Magnetic Resonance Imaging? European urology. 2018; 73: 343-50.
Boesen L, Norgaard N, Logager V, Balslev I, Thomsen HS. Multiparametric MRI in men with clinical suspicion of prostate cancer undergoing repeat biopsy: a prospective comparison with clinical findings and histopathology. Acta Radiol. 2018; 59(3): 371-80.
Hansen NL, Barrett T, Kesch C, Pepdjonovic L, Bonekamp D, O'Sullivan R, et al. Multicentre evaluation of magnetic resonance imaging supported transperineal prostate biopsy in biopsy-naive men with suspicion of prostate cancer. BJU Int. 2018; 122(1): 40-9.
Pepe P, Garufi A, Priolo GD, Galia A, Fraggetta F, Pennisi M. Is it Time to Perform Only Magnetic Resonance Imaging Targeted Cores? Our Experience with 1,032 Men Who Underwent Prostate Biopsy. J Urol. 2018; 200(4): 774-8.
Tae JH, Shim JS, Jin HJ, Yoon SG, No TI, Kim JY, et al. Initial experience of magnetic resonance imaging/ultrasonography fusion transperineal biopsy: Biopsy techniques and results for 75 patients. Investig Clin Urol. 2018; 59(6): 363-70.
Tomaskovic I, Pezelj I, Bolanca Culo K, Novosel L, Nikles S, Tomic M, et al. Diagnostic Value of Cognitive-Registration Multiparametric Magnetic Resonance Guided Biopsy for the Detection of Prostate Cancer after Initial Negative Biopsy. Acta Clin Croat. 2018; 57(Suppl 1): 40-5.
Van der Leest M, Cornel E, Israel B, Hendriks R, Padhani AR, Hoogenboom M, et al. Head-to-head Comparison of Transrectal Ultrasound-guided Prostate Biopsy Versus Multiparametric Prostate Resonance Imaging with Subsequent Magnetic Resonance-guided Biopsy in Biopsy-naive Men with Elevated Prostate- specific Antigen: A Large Prospective Multicenter Clinical Study. European urology. 2018.
Zhou Y, Zhou Z, Li Q, Xu Y, Sun H, Xiao Y, et al. Diagnostic accuracy of magnetic resonance- guided prostate biopsy and template-guided transperineal saturation biopsy. Medicine (Baltimore). 2018; 97(38): e12495.
Alberts AR, Roobol MJ, Verbeek JFM, Schoots IG, Chiu PK, Osses DF, et al. Prediction of High- grade Prostate Cancer Following Multiparametric Magnetic Resonance Imaging: Improving the Rotterdam European Randomized Study of Screening for Prostate Cancer Risk Calculators. European urology. 2019; 75(2): 310-8.
Rouviere O, Puech P, Renard-Penna R, Claudon M, Roy C, Mege-Lechevallier F, et al. Use of prostate systematic and targeted biopsy on the basis of multiparametric MRI in biopsy-naive patients (MRI- FIRST): a prospective, multicentre, paired diagnostic study. Lancet Oncol. 2019; 20(1): 100-9.
Komai Y, Numao N, Yoshida S, Matsuoka Y, Nakanishi Y, Ishii C, et al. High diagnostic ability of multiparametric magnetic resonance imaging to detect anterior prostate cancer missed by transrectal 12- core biopsy. J Urol. 2013; 190(3): 867-73.
Numao N, Yoshida S, Komai Y, Ishii C, Kagawa M, Kijima T, et al. Usefulness of pre-biopsy multiparametric magnetic resonance imaging and clinical variables to reduce initial prostate biopsy in men with suspected clinically localized prostate cancer. J Urol. 2013; 190(2): 502-8.
Abd-Alazeez M, Ahmed HU, Arya M, Charman SC, Anastasiadis E, Freeman A, et al. The accuracy of multiparametric MRI in men with negative biopsy and elevated PSA level--can it rule out clinically significant prostate cancer? Urol Oncol. 2014; 32(1): 45 e17-22.
Pokorny MR, de Rooij M, Duncan E, Schroder FH, Parkinson R, Barentsz JO, et al. Prospective study of diagnostic accuracy comparing prostate cancer detection by transrectal ultrasound-guided biopsy versus magnetic resonance (MR) imaging with subsequent MR-guided biopsy in men without previous prostate biopsies. European urology. 2014; 66(1): 22-9.
Thompson JE, Moses D, Shnier R, Brenner P, Delprado W, Ponsky L, et al. Multiparametric magnetic resonance imaging guided diagnostic biopsy detects significant prostate cancer and could reduce unnecessary biopsies and over detection: a prospective study. J Urol. 2014; 192(1): 67-74.
Pepe P, Garufi A, Priolo G, Pennisi M. Can 3-Tesla pelvic phased-array multiparametric MRI avoid unnecessary repeat prostate biopsy in patients with PSA < 10 ng/mL? Clin Genitourin Cancer. 2015; 13(1): e27-30.
Radtke JP, Kuru TH, Boxler S, Alt CD, Popeneciu IV, Huettenbrink C, et al. Comparative analysis of transperineal template saturation prostate biopsy versus magnetic resonance imaging targeted biopsy with magnetic resonance imaging-ultrasound fusion guidance. J Urol. 2015; 193(1): 87-94.
Thompson JE, van Leeuwen PJ, Moses D, Shnier R, Brenner P, Delprado W, et al. The Diagnostic Performance of Multiparametric Magnetic Resonance Imaging to Detect Significant Prostate Cancer. J Urol. 2016; 195(5): 1428-35.
Fang D, Zhao C, Ren D, Yu W, Wang R, Wang H, et al. Could Magnetic Resonance Imaging Help to Identify the Presence of Prostate Cancer Before Initial Biopsy? The Development of Nomogram Predicting the Outcomes of Prostate Biopsy in the Chinese Population. Ann Surg Oncol. 2016; 23(13): 4284-92.
Mussi TC, Garcia RG, Queiroz MR, Lemos GC, Baroni RH. Prostate cancer detection using multiparametric 3 - tesla MRI and fusion biopsy: preliminary results. Int Braz J Urol. 2016; 42(5): 897-905.
Bonekamp D, Schelb P, Wiesenfarth M, Kuder TA, Deister F, Stenzinger A, et al. Histopathological to multiparametric MRI spatial mapping of extended systematic sextant and MR/TRUS-fusion-targeted biopsy of the prostate. Eur Radiol. 2018.
Huang C, Song G, Wang H, Ji G, Li J, Chen Y, et al. MultiParametric Magnetic Resonance Imaging-Based Nomogram for Predicting Prostate Cancer and Clinically Significant Prostate Cancer in Men Undergoing Repeat Prostate Biopsy. Biomed Res Int. 2018; 2018: 6368309.
Kim JG, Kim CK, Kim JH. Prebiopsy Multiparametric MRI With Cancer-Negative Findings in Men With Suspected Prostate Cancer: Evaluation Using Prostate Imaging Reporting and Data System Version 2. AJR Am J Roentgenol. 2018; 211(1): 121-6.
Kotb AF, Spaner S, Crump T, Hyndman ME. The role of mpMRI and PSA density in patients with an initial negative prostatic biopsy. World J Urol. 2018; 36(12): 2021-5.
Mortezavi A, Marzendorfer O, Donati OF, Rizzi G, Rupp NJ, Wettstein MS, et al. Diagnostic Accuracy of Multiparametric Magnetic Resonance Imaging and Fusion Guided Targeted Biopsy Evaluated by Transperineal Template Saturation Prostate Biopsy for the Detection and Characterization of Prostate Cancer. J Urol. 2018; 200(2): 309-18.
Sathianathen NJ, Konety BR, Soubra A, Metzger GJ, Spilseth B, Murugan P, et al. Which scores need a core? An evaluation of MR-targeted biopsy yield by PIRADS score across different biopsy indications. Prostate Cancer Prostatic Dis. 2018; 21(4): 573-8.
Washino S, Kobayashi S, Okochi T, Kameda T, Konoshi T, Miyagawa T, et al. Cancer detection rate of prebiopsy MRI with subsequent systematic and targeted biopsy are superior to non-targeting systematic biopsy without MRI in biopsy naive patients: a retrospective cohort study. BMC Urol. 2018; 18(1): 51.
Hwang SI, Lee HJ, Lee SE, Hong SK, Byun SS, Lee SC, et al. Value of MR-US fusion in guidance of repeated prostate biopsy in men with PSA<10ng/mL. Clin Imaging. 2019; 53: 1-5.
Otti VC, Miller C, Powell RJ, Thomas RM, McGrath JS. The diagnostic accuracy of multiparametric magnetic resonance imaging before biopsy in the detection of prostate cancer. BJU Int. 2019; 123(1): 82-90. [82] Dikaios N, Alkalbani J, Sidhu HS, Fujiwara T, Abd-Alazeez M, Kirkham A, et al. Logistic regression model for diagnosis of transition zone prostate cancer on multi-parametric MRI. Eur Radiol. 2015; 25(2): 523-32.
Zhao C, Gao G, Fang D, Li F, Yang X, Wang H, et al. The efficiency of multiparametric magnetic resonance imaging (mpMRI) using PI-RADS Version 2 in the diagnosis of clinically significant prostate cancer. Clin Imaging. 2016; 40(5): 885-8.
Morote J, Celma A, Roche S, de Torres IM, Mast R, Semedey ME, et al. Who Benefits from Multiparametric Magnetic Resonance Imaging After Suspicion of Prostate Cancer? Eur Urol Oncol. 2018. [85] Mussi TC, Martins T, Garcia RG, Filippi RZ, Lemos GC, Baroni RH. Are Dynamic Contrast- Enhanced Images Necessary for Prostate Cancer Detection on Multiparametric Magnetic Resonance Imaging? Clin Genitourin Cancer. 2017; 15(3): e447-e54.
Kasivisvanathan V, Dufour R, Moore CM, Ahmed HU, Abd-Alazeez M, Charman SC, et al. Transperineal magnetic resonance image targeted prostate biopsy versus transperineal template prostate biopsy in the detection of clinically significant prostate cancer. J Urol. 2013; 189(3): 860-6.
Sonn GA, Chang E, Natarajan S, Margolis DJ, Macairan M, Lieu P, et al. Value of targeted prostate biopsy using magnetic resonance-ultrasound fusion in men with prior negative biopsy and elevated prostate- specific antigen. European urology. 2014; 65(4): 809-15.
Abd-Alazeez M, Kirkham A, Ahmed HU, Arya M, Anastasiadis E, Charman SC, et al. Performance of multiparametric MRI in men at risk of prostate cancer before the first biopsy: a paired validating cohort study using template prostate mapping biopsies as the reference standard. Prostate Cancer Prostatic Dis. 2014; 17(1): 40-6.
Rais-Bahrami S, Siddiqui MM, Turkbey B, Stamatakis L, Logan J, Hoang AN, et al. Utility of multiparametric magnetic resonance imaging suspicion levels for detecting prostate cancer. J Urol. 2013; 190(5): 1721-7.


